|
|||
|
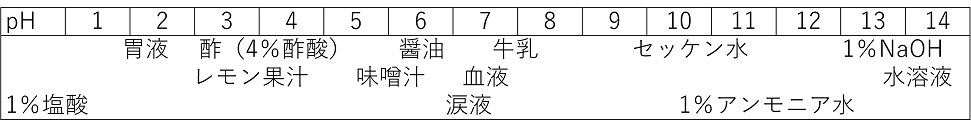
1 酸とアルカリか 【酸とアルカリの定義】 酸の定義 酸は水溶液中で電離して〔 水素イオン(H+) 〕を出す物質である。酸には次のような物質があり,「~酸」と呼ばれるものが多い。 酸の例 塩酸〔 HCl 〕,硝酸〔 HNO3 〕,硫酸〔 H2SO4 〕,炭酸〔 H2CO3 〕,リン酸〔 H3PO4 〕など (塩酸は塩化水素HClの水溶液のことである。その他の酸は水溶液でも水溶液でなくても同じ呼び方になる。ここでは,便宜的に塩酸の化学式をHClとしている。) 塩酸を除いたこれらの物質は,「~酸イオン」の陰イオンとH+がイオン結合したものに相当する。そのため,「~酸」が電離すると,H+と「~酸イオン」に電離する。塩酸の場合はH+と塩化物イオンに電離する。例の酸を電離させると次のようになる。出てくるH+の数に注意しよう。 HCl → 〔 H+ 〕 + 〔 Cl- 〕(塩化物イオン) HNO3 → 〔 H+ 〕 + 〔 NO3- 〕(硝酸イオン) H2SO4 → 〔 2H+ 〕 + 〔 SO42- 〕(硫酸イオン) H2CO3 → 〔 2H+ 〕 + 〔 CO32- 〕(炭酸イオン) H3PO4 → 〔 3H+ 〕 + 〔 PO43- 〕(リン酸イオン) アルカリの定義 アルカリは水溶液中で電離して〔 水酸化物イオン(OH-) 〕を出す物質である。アルカリには次のような物質があり,「水酸化~」と呼ばれるものが多い。また,アンモニアもアルカリの1つである。 アルカリの例 水酸化ナトリウム〔 NaOH 〕,水酸化カリウム〔 KOH 〕, 水酸化カルシウム〔 Ca(OH)2 〕,水酸化バリウム〔 Ba(OH)2 〕など これらの物質は,「~イオン」などの陽イオンとOH-がイオン結合したものに相当する。そのため,「水酸化~」が電離すると,「~イオン」とOH-に電離する。例のアルカリを電離させると次のようになる。でてくるOH-の数に注意しよう。 NaOH → 〔 Na+ 〕(ナトリウムイオン) + 〔 OH- 〕 KOH → 〔 K+ 〕(カリウムイオン) + 〔 OH- 〕 Ca(OH)2 → 〔 Ca2+ 〕(カルシウムイオン) + 〔 2OH- 〕 Ba(OH)2 → 〔 Ba2+ 〕(バリウムイオン) + 〔 2HO- 〕 酸,アルカリになる気体 二酸化炭素CO2やアンモニアNH3は水に溶けるとそれぞれ酸,アルカリになる。これは次のように水と反応してH+,OH-を生成するからである。 二酸化炭素が水と反応すると, CO2 + H2O → 2H+ + CO32- アンモニアが水と反応すると, NH3 + H2O → NH4+ + OH- アンモニウムイオン 【酸,アルカリの性質】 酸のはたらきを示す性質を〔 酸性 〕,アルカリのはたらきを示す性質を 〔 アルカリ性 〕という。酸でもアルカリでもない場合は〔 中性 〕という。 酸性の水溶液の性質 ・〔 青 〕色のリトマス試験紙を〔 赤 〕色に変化させる。 ・〔 BTB 〕溶液を〔 緑 〕色から〔 黄 〕色に変化させる。 ・鉄や亜鉛などの〔 イオン化傾向 〕の大きい金属を溶かし,〔 水素 〕を発生させる。 アルカリ性の水溶液の性質 ・〔 赤 〕色のリトマス試験紙を〔 青 〕色に変化させる。 ・〔 BTB 〕溶液を〔 緑 〕色から〔 青 〕色に変化させる。 ・〔 フェノールフタレイン 〕溶液を無色から〔 赤 〕色に変化させる。 【酸性・アルカリ性の強弱とpH】 同じ濃度の酸の溶液でも,酸性の強さには差がある。酸性とは,酸が電離して〔 H+ 〕を放出する性質なので,より電離しやすい酸ほど,酸性が〔 強い 〕といえる。同様に,アルカリ性とはアルカリが電離して〔 OH- 〕を放出する性質なので,より電離しやすいアルカリほどアルカリ性が〔 強い 〕といえる。 一般に,塩酸,硫酸,硝酸は〔 強酸 〕で,その他の多くの酸は〔 弱酸 〕である。また,水酸化ナトリウム,水酸化カリウム,水酸化バリウム,水酸化カルシウムは 〔 強アルカリ 〕で,その他の多くのアルカリは〔 弱アルカリ 〕である。 酸性,アルカリ性の度合いを示す数値が〔 pH 〕である。ここではpHの求め方は解説しないが,数値から酸性,アルカリ性の度合いを判断できるようにする。 中性のpH … 〔 7 〕 酸性のpH … 7よりも〔 小さい 〕。小さいほど〔 強酸性 〕 アルカリ性のpH … 7よりも〔 大きい 〕。大きいほど〔 強アルカリ性 〕 |
|||
 |
|||
|
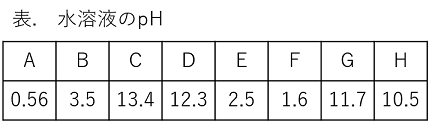
例題 次の水溶液A~Hは,1%塩酸,0.1%塩酸,1%酢酸,0.1%酢酸,1%水酸化ナトリウム,0.1%水酸化ナトリウム,1%アンモニア,0.1%アンモニアのいずれかの水溶液である。各水溶液のpHを下表に記してある。後の問いに答えよ。 |
|||
 |
|||
|
(1) 赤色リトマス試験紙につけると,青変するものを全て選び,A~Hの記号で答えよ。 (2) 青色リトマス試験紙につけると,赤変するものを全て選び,A~Hの記号で答えよ。 (3) A~H にBTB水溶液を加えると,それぞれ何色に変化するか。 (4) フェノールフタレイン溶液を加えると,色が変化するものをするものを全て選び,A~Hの記号で答えよ。また何色に変化するか。 (5) A~Hの水溶液はそれぞれ何の水溶液か。 (1) アルカリ性のもの → pHが7より大きいもの → C,D,G,H (2) 酸性を示すもの → pHが7よりも小さいもの → A,B,E,F (3) C,D,G,H(アルカリ性のもの)… 青 A,B,E,F(酸性のもの)… 黄 (4) C,D,G,H(アルカリ性のもの)… 赤 (5) pHは値が7以上で大きいほど強アルカリ性。水酸化ナトリウムは強アルカリ,アンモニアは弱アルカリ,また,濃い方が強いので,アルカリ性のものを強い順に並べ,pHをあてはめると,1%水酸化ナトリウム=C,0.1%水酸化ナトリウム=D,1%アンモニア=G,0.1%アンモニア=H pHは値が7以下で小さいほど強酸性。塩酸は強アルカリ,酢酸は弱酸性,また,濃い方が強いので,酸性のものを強い順に並べ,pHをあてはめると,1%塩酸=A,0.1%塩酸=F,1%酢酸=E,0.1%酢酸=B
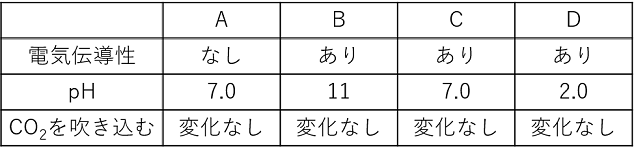
例題 溶液A~Dは次の①~⑤のいずれかである。A~Dの性質を下の表にまとめてある。あとの問いに答えよ。 ① 希塩酸 ② 砂糖水 ③ 食塩水(塩化ナトリウム水溶液)④ 石灰水(水酸化カルシウム水溶液) ⑤ 水酸化ナトリウム水溶液 |
|||
 |
|||
|
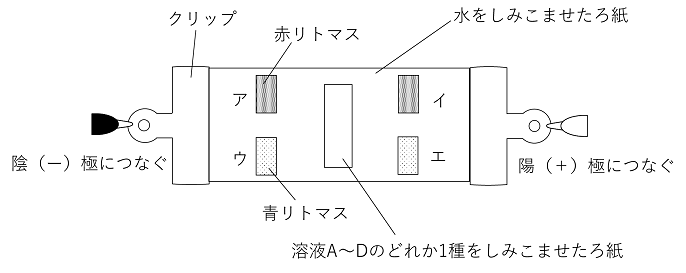
(1) 溶液A~Dはそれぞれどの溶液か,①~⑤の番号で答えよ。 (2) 下の図のように,溶液A~Dのうち1つを染みこませたろ紙を中央において,直流の電流を流すと,A~Dの溶液ではそれぞれリトマス紙がどうなるか答えよ。 |
|||
|
(1) 溶液A~Dはそれぞれどの溶液か,①~⑤の番号で答えよ。 (2) 下の図のように,溶液A~Dのうち1つを染みこませたろ紙を中央において,直流の電流を流すと,A~Dの溶液ではそれぞれリトマス紙がどうなるか答えよ。 |
|||
 |
|||
|
(1) A 伝導性なし → イオンからなる物質ではない → ② B pH=11 → アルカリ性 → ④か⑤ CO2で変化なし → ⑤ C pH=7.0 → ③ D pH=2.0 → ① (2) 電流を流すと,存在する陰イオンは陽極へ,陽イオンは陰極へ移動する。 リトマス紙を変色させるのは,H+とOH-なので,H+があればウが赤くなり,OH-があればイが青くなる。 A イオンでできていないので変化しない B NaOHはNa+とOH- → イが青くなる C NaClはNa+とCl- → 変化しない D HClはH+とCl- → ウが赤くなる |
|||
 |